由于細胞的高度透明性,觀察其中的細胞器十分困難。通過熒光染色,生物學家可以標記特定的細胞器對其進行觀察。絕大部分熒光分子在吸收或發射過程中,表現為有方向的偶極子。通過熒光偏振顯微鏡測量偶極子特性,能夠反映靶分子的取向特性,從而為研究靶分子的空間構象和運動特性提供重要信息。
為了打破傳統熒光偏振顯微鏡受光學衍射限制的問題,諸多超分辨熒光偏振顯微鏡技術被提出,如單分子定向定位顯微鏡(SMOLM)和偏振調制技術(SDOM、SPoD等)。然而,SMOLM在追求高空間分辨率的同時犧牲了時間分辨率,使得快速生物成像成為一項艱巨的挑戰。SDOM等偏振調制技術雖具有較高的時空分辨率,但只能求解偶極子的二維取向,缺乏解析偶極子三維取向的能力。三維取向能夠提供熒光分子更全面的三維空間結構,因此,關鍵問題是如何打破時空分辨率和取向維度之間的權衡,實現超過衍射極限分辨率的同時,能夠快速成像和解析偶極子的三維方向。
針對偶極子取向解析問題,北京大學未來技術學院席鵬教授團隊繼2016年提出二維偶極子取向映射方法SDOM(Light.: Sci. Appl., 2016),及2022年基于光學鎖相探測的二維取向映射方法OLID-SDOM(Light.: Sci. Appl., 2022)后,為打破時空分辨率和三維取向維度的權衡瓶頸,開發了新型的三維取向映射顯微鏡(3DOM)。相關研究成果以“Three-dimensional dipole orientation mapping with high temporal-spatial resolution”為題,于2024年4月16日在線發表在PhotoniX期刊。
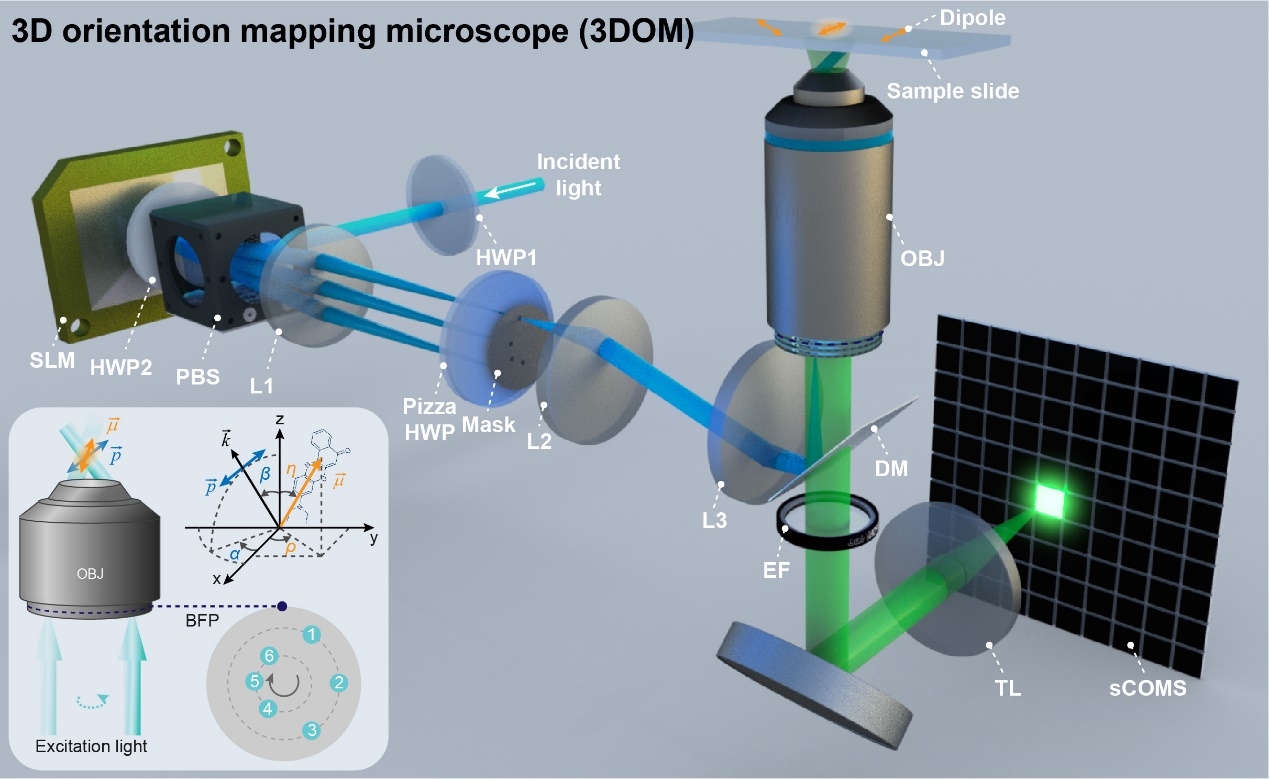
3DOM方法基于團隊開發的偏振結構光超分辨顯微技術,把楊氏雙縫干涉的原理反過來,結合光路可逆的原理,利用不同角度的條紋產生不同方向的正負一級光束。進一步,只需要把相應的負一級次光擋住,就可以產生單一方向的傾斜照明。把這一傾斜投影到z軸不同的角度,利用FISTA算法對圖像進行重建,在倒易空間結合偏振調制系數和重建結果,即可實現高精度的偶極子取向解析。
圖1 三維取向映射顯微鏡原理圖
圖2 SYTOX Orange標記λ-DNA的3DOM成像結果
研究結果表明,3DOM方法有效地克服了偏振
熒光顯微鏡在使用寬場成像進行高時空分辨率和三維方向映射方面的局限性,提供了更全面的熒光團分子的三維空間結構。這不僅能夠應用于區分DNA、膜細胞器以及各種細胞骨架組織的宏觀形態(肌動蛋白絲和微管),而且還可以獲得結構的有序性和結合緊密度等有價值的信息。此外,3DOM的主要優點之一是它易于在現有的寬場系統中升級,適用范圍廣,這增強了其在不同研究環境中的可及性和可用性。可以預見未來3DOM這個強大的工具將會有助于研究人員解析復雜的細胞器結構,推動對眾多生物結構和納米級相互作用的理解,為結構生物學家、生物動力學家帶來新的觀察工具。
席鵬和生命科學學院李美琪老師為本文的共同通訊作者。北京大學未來技術學院博士生鐘素藝為該項成果的第一作者。該研究得到了科技部國家重點研發計劃、國家自然科學基金等項目的支持。
席鵬課題組致力于發展新型超分辨顯微成像技術,在偏振超分辨方面開展了如下工作:(1)利用偏振偶極子解析實現了50nm的超分辨與熒光二維偶極子測量(Light: Science and Applications 2016 ); (2)通過解析結構光超分辨中的偏振信息,實現了偏振SIM超分辨(Nature Communications 2019),并成功實現商業化;(3)結合熒光分子的
化學極性(
光譜紅移)與物理序性(偶極子自由度)信息,成功實現了10種細胞器的同時觀察與環境研究(Nature Communications 2020);(4)通過偏振調制和光學鎖定放大技術來增強微弱的偏振調制信號,實現活細胞中亞細胞結構的熒光各向異性的高靈敏度測量(Light: Science and Applications 2022);(5)發展了具有偶極子方位解析能力的3D-SIM開源軟件Open-3DSIM(Nature Methods 2023 )和開源硬件(Advanced Photonics Nexus 2024);(6)對相關的SIM重建算法進行了系統綜述(Light: Science and Applications 2023) 。

昵稱 驗證碼 請輸入正確驗證碼
所有評論僅代表網友意見,與本站立場無關